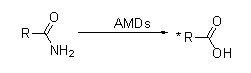
Amidaza (AMD)
Enzymy:Są makromolekularnymi katalizatorami biologicznymi, większość enzymów to białka
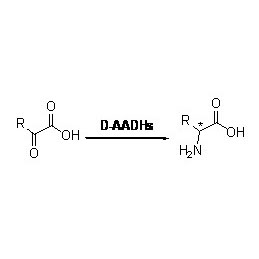
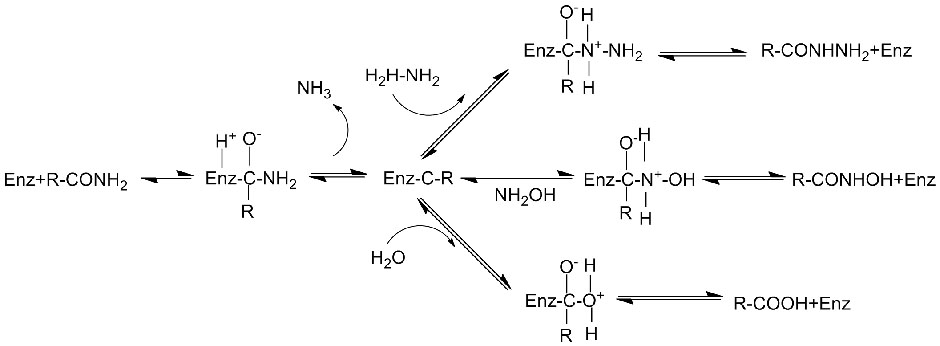
Amidaza:Katalizuj hydrolizę różnych endogennych i obcych alifatycznych i aromatycznych amidów poprzez przeniesienie grupy acylowej do wody z wytworzeniem wolnych kwasów i amoniaku.Kwasy hydroksamowe i inne kwasy organiczne są szeroko stosowane jako leki, ponieważ są składnikami czynników wzrostu, antybiotyków i inhibitorów nowotworów.Amidazy można podzielić na acylazy typu R i typu S zgodnie ze stereoselektywnością katalizatora.
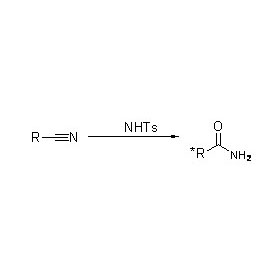
Oprócz katalizowania hydrolizy amidów, amidaza może również katalizować reakcje przeniesienia acylu w obecności kosubstratów, takich jak hydroksyloamina.
Amidazy z różnych źródeł mają różną specyficzność substratową, niektóre z nich mogą hydrolizować tylko amidy aromatyczne, niektóre tylko amidy alifatyczne, a niektóre hydrolizują α- lub ω-aminoamidy.Większość amin ma dobrą aktywność katalityczną tylko dla acyklicznych lub prostych aromatycznych amidów, ale dla złożonych związków aromatycznych amidy heterocykliczne, zwłaszcza amidy z podstawnikami orto, mają na ogół niską aktywność (tylko kilka enzymów wykazuje lepsze efekty katalityczne).
Mechanizm katalityczny:
| Enzymy | Kod produktu | Kod produktu |
| Proszek enzymatyczny | ES-AMD-101~ ES-AMD-119 | zestaw 19 amidaz po 50 mg każda 19 szt * 50 mg / szt lub inna ilość |
| Zestaw do badań przesiewowych (SynKit) | ES-AMD-1900 | zestaw 19 amidaz po 1 mg każda 19 szt. * 1mg/szt. |
★ Wysoka specyficzność substratowa.
★ Silna selektywność chiralna.
★ Wysoka wydajność konwersji.
★ Mniej produktów ubocznych.
★ Łagodne warunki reakcji.
★ Przyjazny dla środowiska.
➢ Badanie przesiewowe enzymów powinno być przeprowadzone dla określonych substratów ze względu na specyficzność substratową i uzyskać enzym, który katalizuje docelowy substrat z najlepszym efektem katalitycznym.
➢ Nigdy nie należy kontaktować się z ekstremalnymi warunkami, takimi jak: wysoka temperatura, wysokie/niskie pH i rozpuszczalnik organiczny o wysokim stężeniu.
➢ Normalnie układ reakcyjny powinien zawierać substrat, roztwór buforowy (Optymalne pH reakcji enzymu).Kosubstraty, takie jak hydroksyloamina, powinny być obecne w układzie reakcyjnym przeniesienia acylu.
➢ AMD powinno być dodawane jako ostatnie do układu reakcyjnego o optymalnym pH i temperaturze reakcji.
➢ Wszystkie rodzaje AMD mają różne optymalne warunki reakcji, dlatego każdy z nich powinien być dalej badany indywidualnie.
Przykład 1(1):
Aktywność hydrolizy do różnych substratów amidowych
| Podłoże | Konkretna czynność μmol min-1mg-1 | Podłoże | Konkretna czynność μmol min-1mg-1 |
| Acetamid | 3,8 | ο-OH benzamid | 1,4 |
| propionamid | 3,9 | p-OH benzamid | 1.2 |
| Laktamid | 12,8 | ο-NH2benzamid | 1,0 |
| Butyramid | 11,9 | p-NH2benzamid | 0,8 |
| izobutyramid | 26,2 | ο-Toluamid | 0,3 |
| Pentanamid | 22,0 | p-Toluamid | 8.1 |
| Heksanamid | 6,4 | Nikotynamid | 1,7 |
| Cykloheksanamid | 19,5 | Izonikotynamid | 1,8 |
| Akrylamid | 10.2 | pikolinamid | 2,1 |
| Metakryloamid | 3,5 | 3-fenylopropionamid | 7,6 |
| prolinamid | 3.4 | Indol-3-acetamid | 1,9 |
| benzamid | 6,8 |
Reakcję prowadzono w 50 mM roztworze buforowym fosforanu sodu, pH 7,5, w temperaturze 70 ℃.
| Amidy | Hydroksylamina | Hydrazyna |
| Acetamid | 8.4 | 1,4 |
| propionamid | 18,4 | 3,0 |
| izobutyramid | 25,0 | 22,7 |
| benzamid | 9,2 | 6,1 |
Reakcję prowadzono w 50 mM roztworze buforowym fosforanu sodu, pH 7,5, w temperaturze 70 ℃.
Stężenie powiązanych reagentów: amidy, 100 mM (benzamid, 10 mM);hydroksyloamina i hydrazyna, 400 mM;enzym 0,9 μM.
Przykład 2(2):
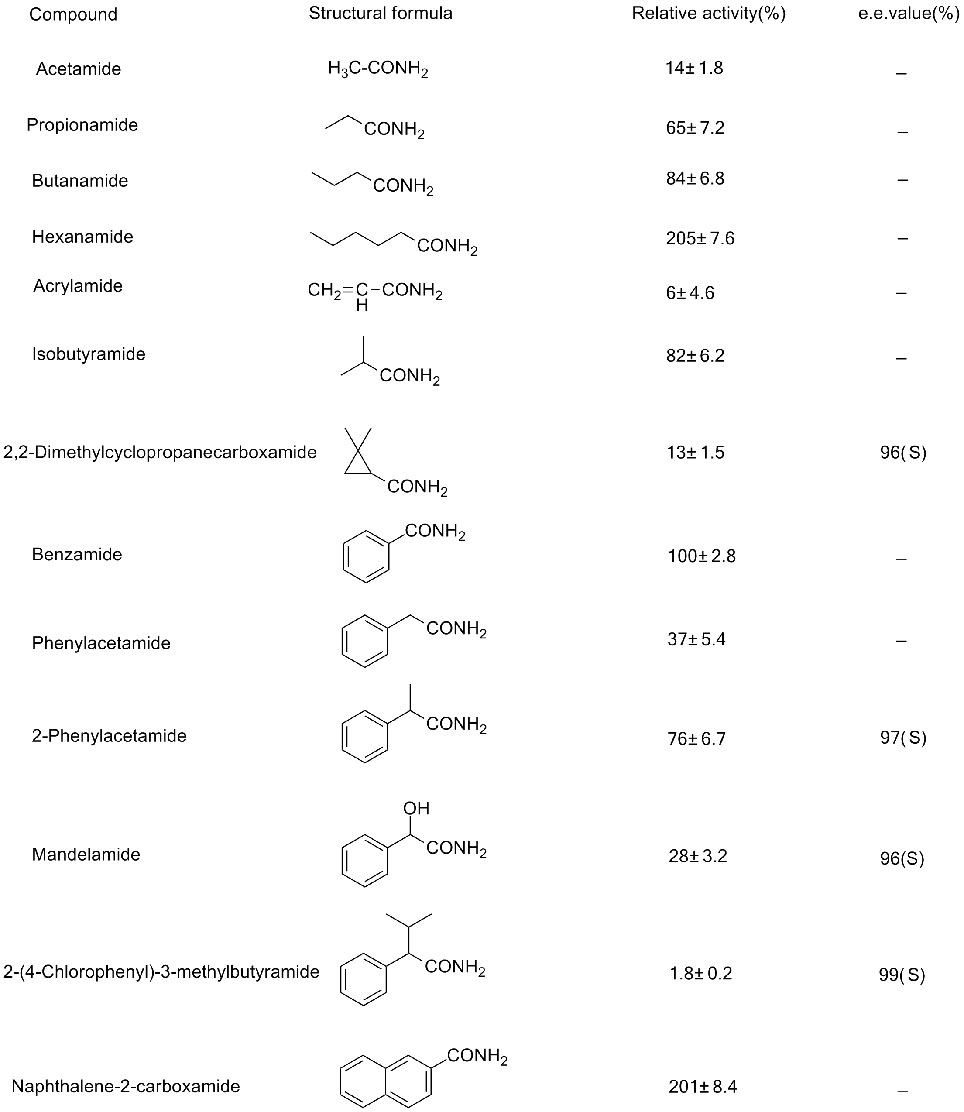
Przykład 3(3):
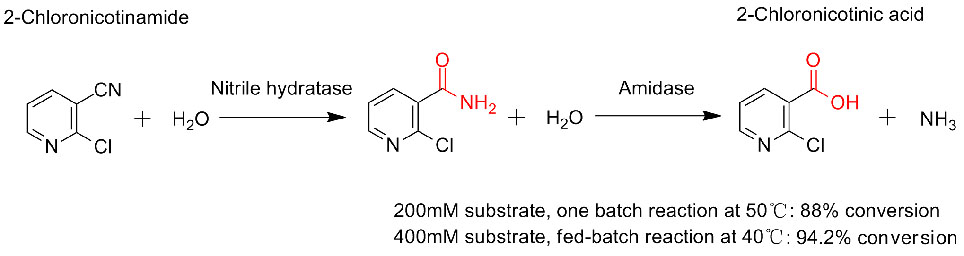
1. D'Abusco AS, Ammendola S., et al.Ekstremofile, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR i in.Biochemia procesowa, 2015, 50(8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM i in.Chemia bioorganiczna, 2017, dostępne online 7.