Unieruchomiony CALB
CALB jest unieruchomiony przez fizyczną adsorpcję na wysoce hydrofobowej żywicy, która jest makroporowatym polimerem styren/metakrylan.Unieruchomiony CALB nadaje się do zastosowań w rozpuszczalnikach organicznych i układach bezrozpuszczalnikowych i może być poddawany recyklingowi i ponownie używany przez wiele razy w odpowiednich warunkach.
Kod produktu: SZ-CALB-IMMO100A, SZ-CALB-IMMO100B.
★ Większa aktywność, wyższa selektywność chiralna i wyższa stabilność.
★ Lepsza wydajność w fazach niewodnych.
★ Łatwe usuwanie z układu reakcyjnego, szybkie kończenie reakcji i unikanie pozostałości białka w produkcie.
★ Można poddać recyklingowi i ponownie wykorzystać, aby obniżyć koszty.
| Działalność | ≥10000PLU/g |
| Zakres pH dla reakcji | 5-9 |
| Zakres temperatur dla reakcji | 10-60 ℃ |
| Wygląd zewnętrzny | CALB-IMMO100-A: jasnożółte do brązowego ciała stałego CALB-IMMO100-B: białe do jasnobrązowego ciała stałego |
| Rozmiar cząsteczki | 300-500 μm |
| Strata przy suszeniu w 105 ℃ | 0,5%-3,0% |
| Żywica do unieruchomienia | Makroporowaty polimer styrenowo-metakrylanowy |
| Rozpuszczalnik reakcji | Woda, rozpuszczalnik organiczny itp. lub bez rozpuszczalnika.W przypadku reakcji w niektórych rozpuszczalnikach organicznych można dodać 3% wody, aby poprawić efekt reakcji |
| Rozmiar cząsteczki | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Definicja jednostki: 1 jednostka odpowiada syntezie 1 μmol na minutę laurynianu propylu z kwasu laurynowego i 1-propanolu w temperaturze 60℃.Powyższe CALB-IMMP100-A i CALB-IMMO100-B odpowiadają unieruchomionym nośnikom o różnych rozmiarach cząstek.
1. Typ reaktora
Immobilizowany enzym stosuje się zarówno w reaktorze okresowym kotłowym, jak i reaktorze ze złożem stałym, z przepływem ciągłym.Należy zauważyć, że podczas karmienia lub napełniania należy unikać zgniatania pod wpływem siły zewnętrznej.
2. pH reakcji, temperatura i rozpuszczalnik
Immobilizowany enzym powinien być dodany jako ostatni, po dodaniu i rozpuszczeniu innych materiałów oraz dostosowaniu pH.
Jeżeli zużycie substratu lub tworzenie produktu doprowadzi do zmiany pH podczas reakcji, do układu reakcyjnego należy dodać wystarczającą ilość buforu lub należy monitorować i regulować pH podczas reakcji.
W zakresie tolerancji temperatury CALB (poniżej 60 ℃) współczynnik konwersji wzrastał wraz ze wzrostem temperatury.W praktyce temperatura reakcji powinna być dobrana zgodnie z trwałością podłoża lub produktu.
Ogólnie reakcja hydrolizy estru jest odpowiednia w układzie fazy wodnej, podczas gdy reakcja syntezy estru jest odpowiednia w układzie fazy organicznej.Rozpuszczalnikiem organicznym może być etanol, tetrahydrofuran, n-heksan, n-heptan i toluen lub odpowiedni mieszany rozpuszczalnik.W przypadku reakcji w niektórych rozpuszczalnikach organicznych można dodać 3% wody, aby poprawić efekt reakcji.
3. Ponowne użycie i żywotność CALB
W odpowiednich warunkach reakcji CALB można odzyskać i ponownie wykorzystać, a konkretne czasy aplikacji różnią się w zależności od projektów.
Jeśli odzyskany CALB nie jest używany w sposób ciągły i musi być przechowywany po odzyskaniu, należy go umyć, wysuszyć i zamknąć w temperaturze 2-8 ℃.
Po kilku rundach ponownego użycia, jeśli wydajność reakcji jest nieznacznie zmniejszona, CALB można odpowiednio dodać i kontynuować stosowanie.Jeśli wydajność reakcji zostanie poważnie zmniejszona, należy ją wymienić.
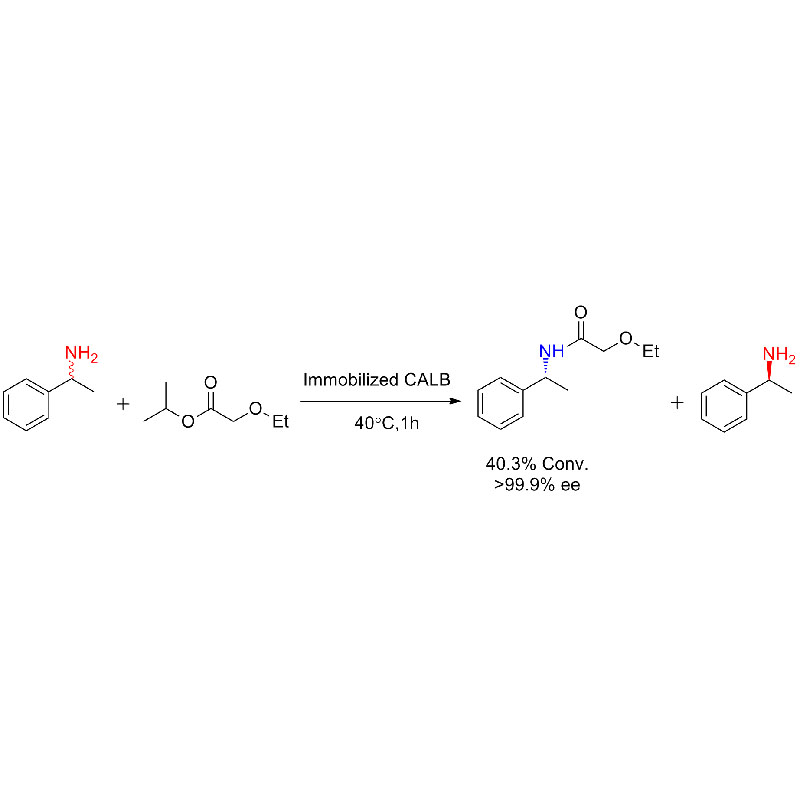
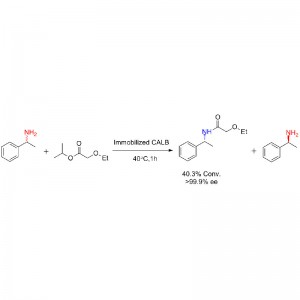
Przykład 1 (aminoliza)(1):
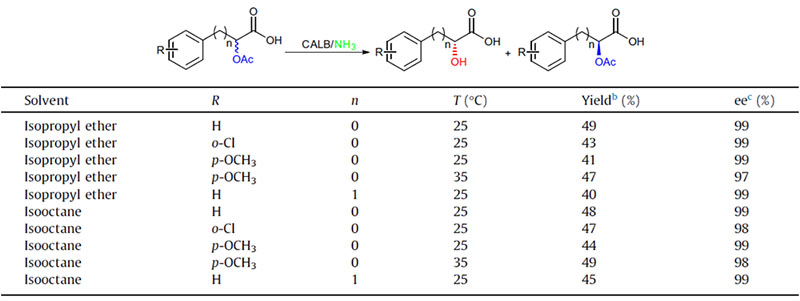
Przykład 2 (aminoliza)(2):
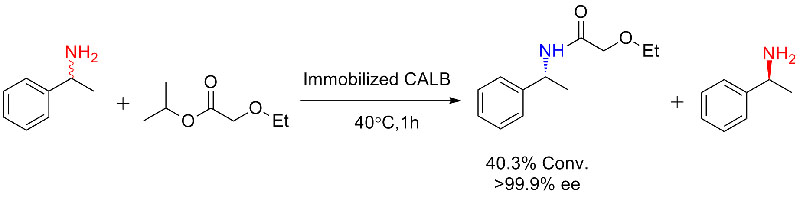
Przykład 3 (synteza poliestru z otwarciem pierścienia)(3):
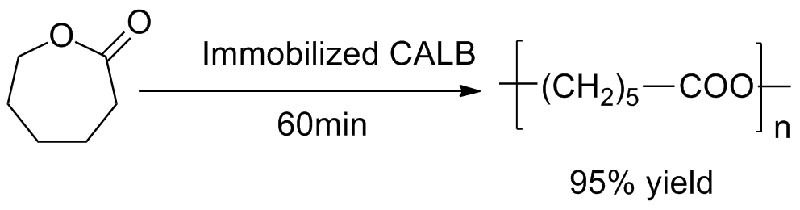
Przykład 4 (Transestryfikacja, regioselektywna grupy hydroksylowej)(4):
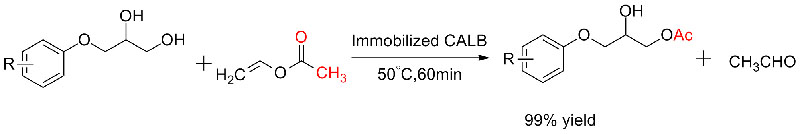
Przykład 5 (Transestryfikacja, rozdział kinetyczny racemicznych alkoholi)(5):
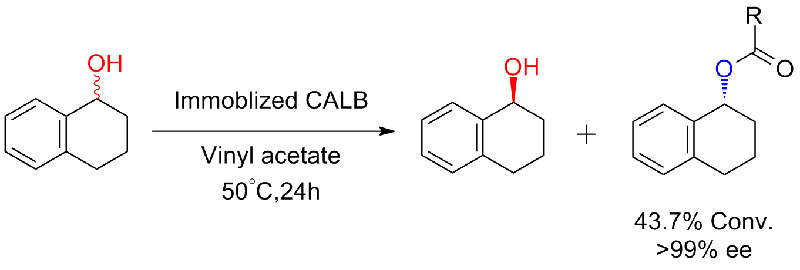
Przykład 6 (Estryfikacja, rozdział kinetyczny kwasu karboksylowego)(6):
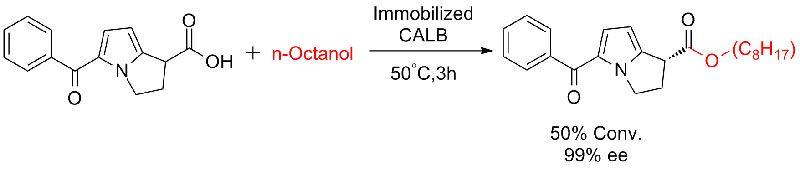
Przykład 7 (Esteroliza, rozdział kinetyczny)(7):
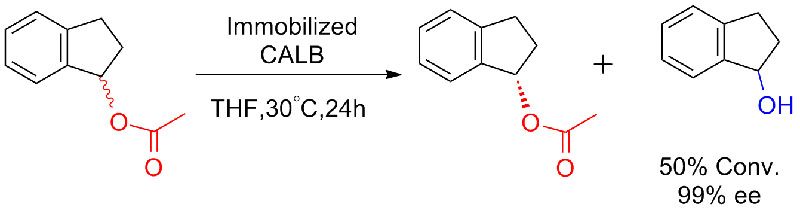
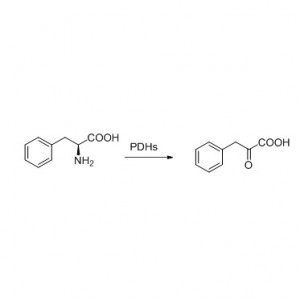
Przykład 8 (Hydroliza amidów)(8):
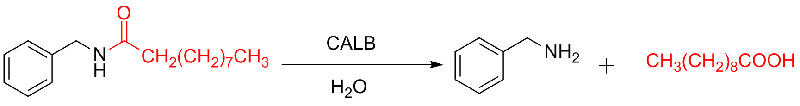
Przykład 9 (Acylowanie amin)(9):
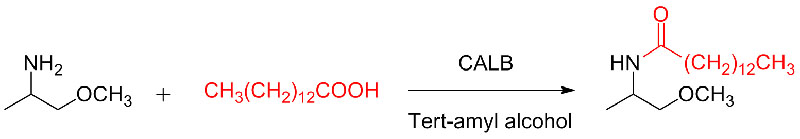

Przykład 10 (reakcja addycji Aza-Michaela)(10):
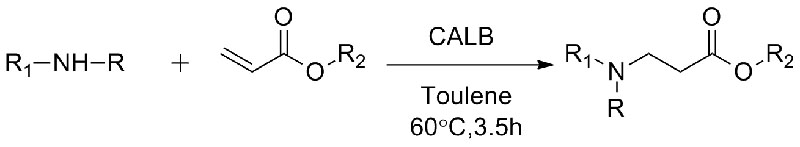
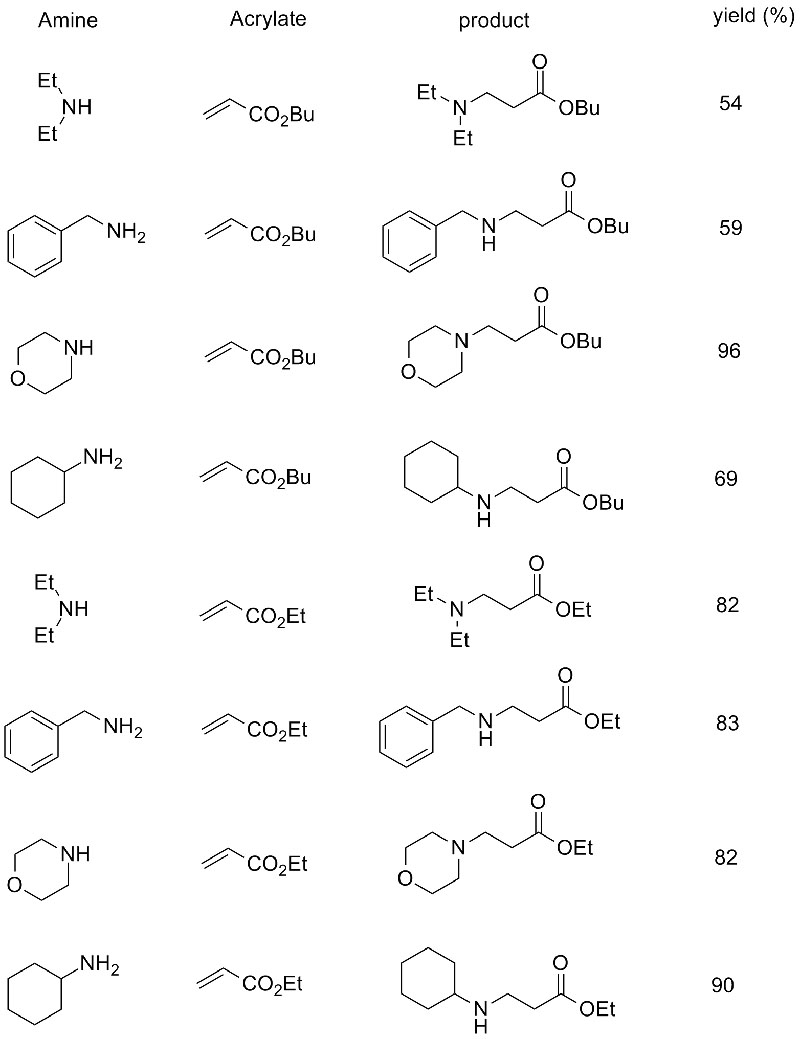
1. Chen S, Liu F, Zhang K i in.Czworościan Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, Anszky GH, et al.Czworościan, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. inż.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Kat.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA i in.J. Mol.Kat.B: Enzym, 2016, 130: 58-69.
8. Gavil´an AT, Castillo E, L´opez-Mungu´AJ Mol.Kat.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. Mol.Kat.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS i in.Tetrahedron Lett, 2010, 51: 4455-4458.